1 Qual o pH de uma solução cuja concentração hidrogeniônica ([H+] é 10-8 ?
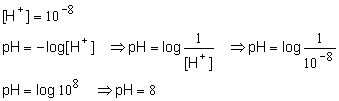
2. Calcular o pH de um meio cuja concentração hidrogeniônica é 0,01 mol/L.

3. Qual é o pH de uma solução cuja concentração hidroxiliônica é de 0,1 mol/L?

4. Uma solução apresenta concentração hidrogeniônica igual a 10-11 mol/L. Qual é o seu pOH?

Agora tratando de ácidos e bases reais
5. Calcular o pH de uma solução de ácido clorídrico – HCl – 0,1M

6. Determine o pH de uma solução 0,005M de ácido sulfúrico?
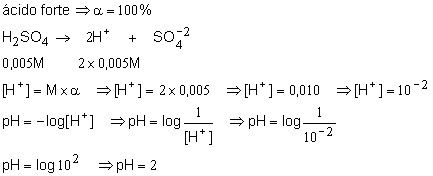
7. Foi preparada uma solução 0,04M de ácido clorídrico (HCl). Descobrir o seu pOH.
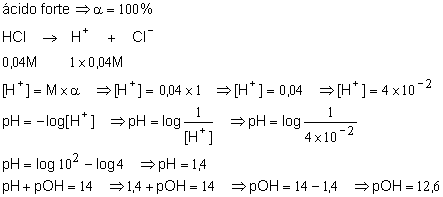
8. Foi preparada uma solução 0,8M de hidróxido de sódio (NaOH). Qual o seu pH?

Vamos fazer um exemplo no qual o ácido é fraco. Neste caso a dica é utilizar a expressão [H+] = M x α pois neste caso apenas uma porcentagem do ácido estará ionizado. Vamos ao exemplo:
O ácido acético (HAc) é o componente principal do vinagre, ele é um ácido orgânico (e como tal é fraco!!). Qual o pH de uma solução 0,2M de HAc, sabendo que, nessa diluição, o grau de ionização é igual a 0,5%?

Qualquer dúvida é só postar!
Um abraço e bons estudos.
Nenhum comentário:
Postar um comentário